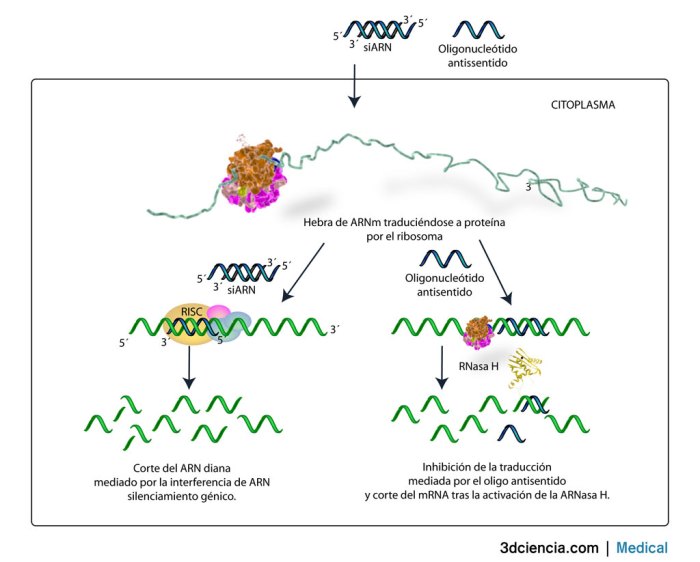
1. Qué es la terapia
génica?
Podemos definir la terapia génica como el proceso por el cual un nuevo gen es
introducido en células de un individuo para producir un efecto terapéutico.
Dicho efecto puede ser una activación o una supresión de alguna función
fisiológica que se está produciendo incorrectamente en el individuo a
tratar.
Analicemos un poco más los dos efectos terapéuticos que este gen introducido
puede realizar. En el caso de activar una función, podemos fijarnos en el caso
de la inmunodeficiencia combinada severa donde la enzima ADA (adenosin
desaminasa) está fallando. Lo que se ha intentado en esta enfermedad es
introducir el gen que codifica para esta enzima de forma que realice la función
que en el organismo no está realizando correctamente. Hoy en día sigue en
experimentación aunque ya en fase I y II en humanos.
Respecto a suprimir una función que está siendo errónea o perjudicial para el
organismo, podemos fijarnos en el caso del cáncer. En esta enfermedad, hay una
proliferación incontrolada de células tumorales que causan un daño en el
organismo. La terapia génica en este caso intenta suprimir a esas células
tumorales introduciendo genes que denominaremos "asesinos" hacia estas células
defectuosas para eliminarlas, evitando así la proliferación de éstas y por tanto
el desarrollo incontrolado del tumor. El tratamiento del melanoma fue una de las
primeras pruebas realizadas.
Los tipos de terapia génica existentes respecto al modo de introducir el gen
en el organismo pueden ser clasificados en "in vivo" y "ex vivo". La terapia
génica "ex vivo" consiste en la realización de una primera fase en el
laboratorio, de modo que obtenemos células modificadas genéticamente (contiene
el gen que queremos expresar en el organismo) y que posteriormente
introduciremos en el individuo. La terapia génica "in vivo" consiste en la
introducción del gen mediante un vehículo para que lo inserte en las células del
paciente. Estos vehículos son los llamados vectores (también utilizados "in
vitro").
Antes de explicar más detalladamente el modo de introducción del transgén y
ver las enfermedades en las que se aplica la terapia génica, es conveniente
definir de forma clara qué es un transgén, también denominado construcción
genética. Podríamos definirlo como un conjunto de uno o más genes y secuencias
reguladoras que controlan la expresión de éste. Este transgén es el que tiene la
función terapéutica, y es el que la terapia génic Hasta el momento no se ha
realizado ninguna experiencia, a pesar de ser lo más idóneo en un tratamiento,
debido a su dificultad.
Actualmente la mayoría de las experiencias se están realizando en modelos
animales, pero también existen ya ensayos clínicos en humanos. Para conocer en
qué situación se encuentran dichos ensayos clínicos se puede visitar la página
web http://www.wiley.co.uk/wilechi/genmed/clinical/related-sites.htm
actualizada de forma continua y donde podemos encontrar: las enfermedades que se
están tratando, los vectores que se están utilizando, los países que lo llevan a
cabo y los resultados de las experiencias realizadas.
Como datos más interesantes podemos decir que el 50% de las pruebas se están
llevando a cabo con vectores retrovirales, siendo la enfermedad más sometida a
este tipo de pruebas el cáncer. Estados Unidos es el país donde se están
realizando mayor número de experiencias seguido por la Unión Europea.
2. Introducción del
transgén
A pesar de que no es fácil la clasificación, hemos creído conveniente dividir
el modo de introducción en dos tipos: los directos y los que utilizan
determinados vehículos (sistemas indirectos).
2.1- Métodos directos
SISTEMAS QUÍMICOS
Transferencia con fosfato de calcio
Se empezó a usar esta técnica en los años 60, pero fue en los 70 cuando se
empezó a desarrollar suficientemente para tener buenas eficacias de
transfección. Se basa en la precipitación del DNA exógeno y los iones de calcio,
provocando que la célula, mediante endocitosis, introduzca el DNA en su
interior. La eficacia de transfección puede llegar al 10% de las células, aunque
suele ser transitoria.
No es una técnica que provoque toxicidad en las células pero la expresión del
transgen es muy pequeña. Únicamente se usa en cultivos celulares, y por lo tanto
su aplicación es "ex vivo".
SISTEMAS FÍSICOS
Microinyección
Consiste en colocar el DNA mediante una inyección en el núcleo de las
células. Al introducirlo directamente allí, evitamos la degradación
citoplasmática y lisosomal. Se realiza mediante un micromanipulador, microscopio
invertido que permite la visualización.
Las células que sobreviven y han insertado el material genético presentan una
alta eficacia de expresión del mismo. La técnica es muy laboriosa y necesita
células aisladas para su realización. Este sistema se suele utilizar "ex vivo".
En el caso de inyección en embriones se denomina terapia génica germinal siendo
un método "in vivo".
Electroporación
Se introduce la construcción génica mediante un choque eléctrico a las
células que provoca la formación de poros en sus membranas , por donde entra el
transgén. Está especialmente indicado para células con una alta tasa de
proliferación. Sin embargo, muchas células mueren al no soportar el choque
eléctrico por lo que muchas veces no es la forma más indicada en algunos tipos
celulares.
DNA desnudo
Consiste en la introducción del DNA en una solución salina o sérica,
normalmente mediante inyección intramuscular, para conseguir la expresión del
transgén. Se ha observado actualmente expresión en timo, piel, músculo cardíaco
y músculo esquelético. No se conoce el mecanismo por el que llega a entrar a la
célula aunque se postula que es a través del complejo del poro nuclear.
Tiene un bajo porcentaje de células transfectadas, no hay integración en el
genoma y una vez inyectado no hay replicación en el genoma. Este es un sistema
utilizado para la realización de la terapia génica "in vivo".
2.2- Métodos directos (mediados por vectores)
VECTORES NO VIRALES
Liposomas
En 1965 se descubrió que los liposomas (bolsas rodeadas de una membrana
lipídica a semejanza de una célula eucariota animal) eran capaces de hacer
entrar DNA en la célula, pero hasta 1980 no se consiguió una eficacia de
transfección adecuada. Existen dos tipos de liposomas: liposomas catiónicos y
liposomas aniónicos.
Liposomas catiónicos
Se encuentran cargados positivamente por lo que interaccionan con la carga
negativa del DNA. Existen muchos lípidos que se usan para formar estos liposomas
e incluso se están probando mezclas de estos. Son recomendables en
transfecciones "in vitro".
Las ventajas de los liposomas es que protegen de la degradación al transgén
hasta su llegada al núcleo. La talla del DNA introducido en ellos no tiene
límite. Podemos hacerlos llegar a tejidos específicos incluyendo receptores en
la capa lipídica.
Sin embargo como desventaja presentan la baja eficacia de
transfeción, una expresión transitoria, cierto grado de toxicidad celular y
pueden ser inhibidos por componentes séricos.
Biolística o Gene-gun
Consiste en el bombardeo de los tejidos con partículas de oro o tungsteno que
llevan adheridas a ellas el DNA. El bombardeo se realiza mediante una descarga
con helio como si fuera una pistola (de allí el nombre de la técnica).
La capacidad de penetración es limitada usándose en líneas celulares,
epidermis, músculo e hígado. Su expresión es transitoria y en la zona de
descarga se produce una gran muerte celular. Esta técnica puede realizarse "ex
vivo" (en el caso de células animales) e "in vivo" (en el caso de células
vegetales).
Vectores virales
Esta metodología comienza en 1968 cuando se demuestra que los virus son
capaces de infectar células de mamífero. El desarrollo en 1989 de las células
empaquetadoras (aportan la composición proteica que necesitan los virus para su
funcionalidad ya que ésta ha sido eliminada del genoma viral) supuso un avance
importante en esta metodología al aumentar la titulación en virus no patógenos.
En todos los casos vamos a eliminar el mayor número de genes y secuencias al
virus para que pueda captar el DNA exógeno. Los vectores virales pueden ser
utilizados tanto "in vivo" como "ex vivo". Hasta el momento los virus más
utilizados en terapia génica son los siguientes:
- Retrovirus
Son virus ARN que tienen capacidad para integrar genes terapéuticos
relativamente grandes (un máximo de 8 Kb). Necesitan de células empaquetadoras
para su obtención. Se transfiere el DNA del virus mediante la técnica del
fosfato de calcio a las células empaquetadoras. Posteriormente se realiza una
segunda transducción en la cual introducimos la construcción génica de
interés.
Los virus inyectados en el huésped integran su DNA en el genoma del huésped
expresando así el gen que le hemos añadido. Como las proteínas del virus no son
expresadas por el huésped, no tenemos una respuesta inmunitaria. Tienen una alta
eficacia de transducción y también de expresión, siendo un sistema bien
estudiado.
Sin embargo, únicamente sirven para infectar células del huésped que se
encuentran en división. Además los títulos de virus obtenidos hasta ahora son
bajos y la integración en el genoma es al azar.
Existen también vectores basados en el virus del SIDA (HIV), cuyo genoma es
más complejo pero con un funcionamiento similar al que hemos visto. Son los
denominados lentivirus.
- Adenovirus
Son una familia de virus ADN que causan infecciones en el tracto respiratorio
humano. Se pueden llegar a insertar en ellos hasta 7.5 Kb. de DNA exógeno.
Normalmente en terapia génica se utiliza el serotipo 5, aunque existen hasta 42
serotipos diferentes que infectan a humanos.
En este caso no se necesita la integración del material hereditario del virus
en el del huésped para su replicación, por lo tanto tampoco el transgén será
introducido en el genoma de la célula. Y por tanto tampoco necesitan que las
células infectadas estén dividiéndose para su replicación.
La gran ventaja de usar un adenovirus como vector es la alta eficacia de
transducción, al igual que la expresión de la construcción génica introducida,
sin embargo ésta es transitoria (pocas semanas). Esto último obligaría a
tratamientos periódicos lo cual es un inconveniente ya que los adenovirus
producen respuesta inmune celular e inflamatoria.
- Virus adenoasociados (VAA)
Son parvovirus, contienen DNA como material genético, y requieren la
coinfección con un adenovirus para multiplicarse. Son vectores que combinan las
ventajas de los retrovirales y los adenovirales. Su capacidad de integrar DNA
exógeno es pequeña, sólo de 5 Kb.
Las principales ventajas son que los virus adenoasociados integran su DNA en
la célula durante la replicación, por lo que la transducción (la cual es
altamente eficaz) es estable en la célula diana. Además pueden infectar tanto a
células en división como a las que no lo están (de gran importancia para la
terapia génica "in vivo"). Los vectores AAV no están implicados en ningún tipo
de enfermedad humana. Además el riesgo de una respuesta inmune está minimizado
ya que no produce proteínas víricas.
Sin embargo existen también una serie de inconvenientes como que este tipo de
vectores todavía no ha sido tan bien estudiado como los retrovirus y los
adenovirus.
- Herpesvirus
Son virus DNA cuyas células diana son las neuronas. Su complejidad y lo poco
que todavía conocemos de esta familia de virus dificulta su utilización.
La gran ventaja es el gran tamaño de su DNA , que les permite aceptar varios
genes terapéuticos, incluso podrían ir con sus propias regiones reguladoras.
Uno de los inconvenientes es que habría que eliminar las secuencias que
codifican para las proteínas líticas del virus que causan la muerte de las
células a las que infectan.
Como resumen de los vectores, podemos hacer una recopilación de las
características que deberían presentar para obtener el vector ideal para su uso
en terapia génica:
- permitir la incorporación y expresión regulada durante
el tiempo conveniente, de uno o más genes necesarios para la aplicación clínica
requerida
- ser específico en su transferencia génica
- ser
irreconocible para el sistema inmune y no inducir respuesta inflamatoria
-
ser estable y fácil de obtener
3. Enfermedades candidatas a la terapia
génica
Contrariamente a lo que en principio se pensaba, las enfermedades hacia las
que se ha dirigido la terapia génica no siempre corresponden a enfermedades
genéticas. Entre las pruebas realizadas se han propuesto distintos tipos de
patologías a tratar con esta metodología:
* enfermedades monogénicas
* cáncer
* enfermedades infecciosas
*
otras enfermedades
Trataremos sobre los tres primeros apartados, comentando algunos ejemplos de
enfermedades que ya se encuentran en ensayos clínicos con humanos:
3.1- Enfermedades monogénicas
INMUNODEFICIENCIA COMBINADA SEVERA
El gen defectuoso codifica una parte de un receptor celular que envía las
señales a los progenitores de las células T y NK, componentes cruciales del
sistema inmunitario. Sin el mando de este gen, las células no se desarrollan, no
crecen y tampoco proliferan. Los pacientes están indefensos frente a la más leve
infección. Los afectados están obligados a vivir en el interior de una burbuja
estéril, bajo un estricto control hasta que se sometan a un trasplante de médula
ósea.
En la actualidad existen 8 grupos de investigadores trabajando en esta
enfermedad en fase I ó II. En todos los casos usan como gen terapeútico la
adenosin desaminasa, y como vector un retrovirus, variando las células diana a
las que va dirigido el vector así como la vía de administración de éste.
FIBROSIS QUISTICA
La fibrosis quística es una enfermedad heriditaria, autosómica recesiva
frecuente en la raza caucásica (el gen defectuoso codifica para el canal de
cloro conocido como CFTR). Se trata de una enfermedad generalizada de las
glándulas exocrinas, caracterizada por un transporte anormal de electrolitos,
que conduce a una enfermedad crónica obstructiva de los pulmones, insuficiencia
pancreática exocrina y aumento de la cantidad de electrolitos en el sudor.
La enfermedad suele manifestarse por problemas respiratorios asociados con
manifestaciones digestivas, diarrea crónica y retraso del crecimiento. Esta es
la forma de presentación más frecuente. Sin embargo, a lo largo de la vida
pueden aparecer signos y síntomas que configuran la historia natural de la
enfermedad.
Actualmente existen 27 líneas de investigación en fase I ó II que en la
mayoría de los casos (25 de ellos) utilizan como transgén CFTR, como células
diana, las células del epitelio del tracto respiratorio (nasal y bronquial),
siendo la via de administración en forma de aerosol. La única diferencia entre
unos casos y otros son los vectores utilizados: liposomas y adenovirus.
HEMOFILIA
Existen dos tipos de hemofilia: la hemofilia "A" donde falla el factor VIII
c: coagulante y la hemofilia "B", donde falla el factor IX c: coagulante.
Un hemofílico que padezca hemofilia A o hemofilia B, no sangra con mayor
rapidez que las demás personas, sino que sangra más tiempo del habitual, y como
su proceso de coagulación no es el normal, precisa administrarse el factor
carente o deficitario de la coagulación con el fin de alcanzar unos niveles
óptimos que le permitan una buena coagulación y pare el sangrado.
La hemofilia se manifiesta en forma de hemorragias, que pueden ser
espontáneas o producidas por algún golpe o trauma. Las hemorragias internas que
pueden empezar de forma espontánea sin causa aparente, si tardan en controlarse
pueden dañar las articulaciones y los músculos. Este tipo de hemorragia puede
ser incluso más grave que las hemorragias que afloran al exterior, aunque éstas
sean más llamativas.
Hoy en día existen 6 líneas de investigación en fase I ó II, de las cuales 3
estudian la hemofilia A, usando como transgén el factor VIII, y las otras 3 la
hemofilia B, usando como transgen el factor IX. Las 6 líneas son muy diversas:
- vectores utilizados: retrovirus, adenovirus, virus adenoasociados, DNA
desnudo.
- via de administración usadas: subcutánea, intramuscular,
intrahepática, intraperitoneal, intravenosa.
Existen más enfermedades que se están tratando las cuales pueden ser
consultadas en la página web: http://www.wiley.co.uk/genetherapy/clinical/.
CÁNCER
El cáncer es una enfermedad que se caracteriza por el crecimiento excesivo y
descontrolado de células que invaden y dañan tejidos y órganos. Los distintos
cánceres presentan características y comportamientos diferentes, lo cual
dificulta mayormente cualquier tipo de terapia. Por todo ello las
investigaciones preclínicas y clínicas en la terapia génica del cáncer están
orientadas hacia cuatro categorías distintas de estrategias:
- La destrucción de las células tumorales mediante la expresión en ellas de
productos tóxicos, o en su defecto, capaces de activar drogas que sí lo son.
- La estimulación de la respuesta inmune contra el tumor, potenciando los
mecanismos del sistema inmune o modificando las células cancerosas para hacerlas
más susceptibles a su destrucción.
ia (alta virulencia o alto número de afectados) se ha profundizado más en
ellos.
- MELANOMA
El melanoma es una enfermedad de la piel consistente en una transformación
cancerosa (maligna) de los melanocitos , que son las células que dan color a la
piel. El melanoma generalmente ocurre en adultos, pero puede ocasionalmente
encontrarse en niños y adolescentes.
El melanoma es mucho más grave que otros tipos de cánceres de piel, como por
ejemplo los llamados epiteliomas , que se originan en las células basales o
escamosas (otros tipos de células de la epidermis). Como la mayoría de los
cánceres, el melanoma se trata mejor cuando se detecta pronto. El melanoma puede
diseminarse (por metástasis) rápidamente a otras partes del cuerpo a través de
la sangre o del llamado sistema linfático (Los ganglios linfáticos son
estructuras pequeñas en forma de alubia, que se encuentran en todo el cuerpo y
cuya función es producir y almacenar células que combaten las infecciones).
Hasta momento existen 79 grupos investigadores trabajando en fases clínicas I
ó II utilizándose genes que corresponden a moléculas participativas en el
sistema inmune (antígenos, complejo de histocompatibilidad, citoquinas,...). En
la mayoría de los casos las células diana son las células tumorales, siendo
variada la vía de administración y los vectores usados.
- GLIOBLASTOMA
Los tumores primarios del Sistema Nervioso Central (SNC) constituyen
alrededor del 2% del total de las neoplasias en el adulto y el 20% en niños. Los
gliomas son el tipo más frecuente, con una incidencia del 50% en la mayoría de
los casos.
Actualmente existen 19 grupos investigando sobre terapia génica en
glioblastomas. Se ha alcanzado la fase III por parte de algún grupo, siendo
generalmente usados los retrovirus introducida por via intratumoral, tratándose
de una terapia "in vivo". El gen usado más frecuentemente es la tirosina quinasa
(TK).
ENFERMEDADES INFECCIOSAS
- SIDA (Síndrome de Inmunodeficiencia Adquirido)
Las siglas SIDA significan síndrome de inmunodeficiencia adquirida. Es una
enfermedad infecciosa producida por el virus de la inmunodeficiencia humana
(conocido con las siglas VIH) que afecta al sistema inmunitario disminuyendo las
defensas del organismo.
De los 36 casos de estudios de terapia génica para enfermedades infecciosas
en fase clínica, 35 de ellos son sobre el SIDA, todos ellos se encuentran en
fase I ó II. El vector más usado es el retrovirus que se suele aplicar vía
intravenosa. Las células diana son células sanguíneas siendo frecuente
introducir genes de la cápside o la envoltura del virus HIV para que el
organismo las reconozca y reaccione así el sistema inmunitario.
Existen más enfermedades que se están tratando las cuales pueden ser
consultadas en la página web: http://www.wiley.co.uk/genetherapy/clinical/
|